【www.zhuodaoren.com--百科】
【一】:2016年安徽高考化学试卷分析
2016年安徽高考化学试卷分析
2016年安徽高考化学试卷分析
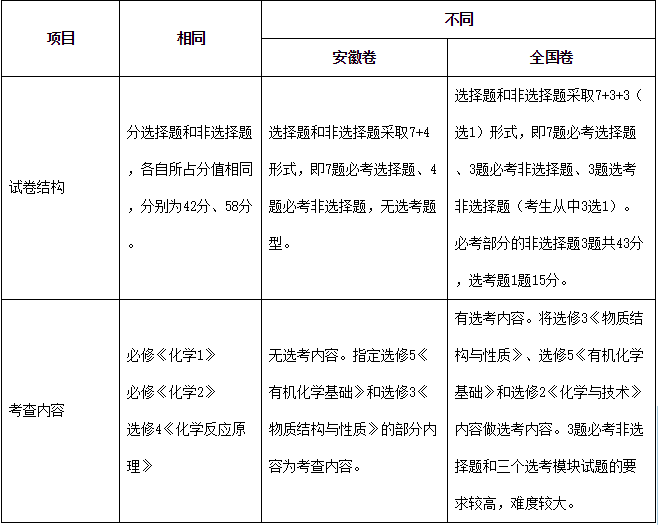
今年的理综化学试题相对于去年的全国卷,化学试题的题型、题量和风格保持稳定,总体难度有所降低。与往年的安徽卷相比,最大的不同是有三道化学选做题,考生可以选择其中任一题来做。今年的这三道选做题难度基本相当,不管选做哪一题的考生都不会吃亏。
试题注重考查化学学科的核心素养,突出考查考生对主干知识、核心概念、重要规律的理解和掌握。如第26题考查基本实验探究能力;第27题考查平衡常数、沉淀溶解平衡、离子方程式的书写等;第28题考查氧化还原反应、混合物的除杂分离等。
试题提供的材料丰富多样,考查考生获取信息、加工信息的能力。这些信息包括实验装置图、电化学装置图、坐标图及数据表、晶胞图、工艺流程图、有机合成路线等形式,而信息中蕴含的物质性质、反应数据和分离方法等是解决试题的关键内容。这就要求考生能够从中概括出新的知识并与原有知识相组合,从而解决问题。如第27题原理综合题与第28题工艺流程题就是提供新信息的典型试题。
试题以生产、生活中的真实过程为情境,将化学研究的思想与方法、概念与原理、物质的性质与应用巧妙融合于试题之中。试题采取废水处理、矿物开发、能量转化、材料制造、资源综合利用等情境设计试题,关注资源再生利用及绿色家园保护,挖掘其中的化学内涵和应用价值,考查学生独立思考、灵活运用所学知识分析问题和解决问题的能力。如第11题用电渗析法处理废水、第28题杀菌消毒剂亚氯酸钠的合成工艺就是实际工业生产为情境的试题。
选做题重视对学习能力和创新能力的考查。在解决陌生的化学问题时,能够考查考生的思维过程和思维深度,这就要求考生能够迅速灵活地形成解决问题的程序。例如在化学选做题中,第37题先给出陌生的名词术语“原子坐标参数”的定义及示例,然后再要求考生写出锗晶胞中的原子坐标参数;第38题要求考生设计对苯二甲酸的合成路线,而解题所需的信息被巧妙地隐藏在题干中,只有细心的考生才可能把它发掘出来并加以利用。此两道题也是今年的高考化学试题中两个亮点。
【二】:安徽省淮南市2016年高考化学一模试卷 Word版含解析
2016年安徽省淮南市高考化学一模试卷
一、选择题:
1.2015年10月,中国女药学家屠呦呦因创制新型抗疟药﹣﹣青蒿素和双氢青蒿素的贡献获得诺贝尔生理学或医学奖.青蒿素和双氢青蒿素的结构式如下图.从青蒿中提取青蒿素主要采用有机溶剂提取的方法.下列有关说法不正确的是( )
A.用有机溶剂从青蒿中提取青蒿素,主要采用萃取的方法
B.青蒿素的分子式为C15H22O5
C.青蒿素通过还原反应可制得双氢青蒿素
D.青蒿素和双氢青蒿素都是芳香族化合物
2.NA为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,0.1molC8H18所含有的共价键数目为2.5NA
B.1L 1 mol•L﹣1 FeCl3溶液完全水解产生的Fe(OH)3胶体粒子数为NA
C.氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA
D.28.6gNa2CO3•10H2O溶于水配成1L溶液,该溶液中阴离子数目为0.1NA
3.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
A.A
B.B C.C D.D
4.某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示.下列有关说法正确的是( )
A.实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2 B.实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
C.实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4═4CuSO4+2NO↑+4H2O D.由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应
5.工业上常用电解硫酸钠溶液联合生产硫酸和烧碱,生产装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法中正确的是( )

A.a极与电源的负极相连
B.产物丙为硫酸溶液
C.离子交换膜d为阴离子交换膜
D.b电极反应式:4OH﹣﹣4e﹣=O2↑+2H2O
6.X、Y、Z、M是四种原子序数依次增大的主族元素.已知X、Y、Z是短周期中的三种
X元素原子的核外电子数等于所在周期数;Y原子的最外层电子数是内层电子非金属元素,www.fz173.com_2016安徽高考化学。
Z单质为无色气体,M是地壳中含量最高的金属元素.数的2倍;性质稳定常用作保护气;下
列说法正确的是( )
A.四种元素的原子半径从大到小的顺序是:M>Z>Y>X
B.元素X、Z可形成某种化合物,其分子内既含极性键又含非极性键
C.化合物YO2、ZO2都能和氢氧化钠溶液反应,均属于酸性氧化物
D.金属M制品具有较强的抗腐蚀能力,说明M元素的金属活动性较差
7.常温下,用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如下图(已知:饱和CO2溶液的pH为5.6),下列说法正确的是 ( )
A.该Na2CO3溶液的浓度为0.001mol/L
B.在pH=7时,c(Na+)=c(Cl﹣)
C.在pH=6时,c(Na+)>c(HCO3﹣)>c(CO32﹣)
D.c→d发生的主要离子反应为:CO32﹣+H+=HCO3﹣
二、非选择题
8.甲酸(HCOOH)是一种有刺激性气味的无色液体,有很强的腐蚀性、较强的还原性.熔点8.4℃,沸点100.7℃,能与水、乙醇互溶,加热至160℃即分解成二氧化碳和氢气.
HCOOH(1)实验室可用甲酸与浓硫酸共热制备一氧化碳:H2O+CO↑,
实验的部分装置如下图所示.制备时先加热浓硫酸至80℃﹣90℃,再逐滴滴入甲酸.
①e(填选项序号)(必要的塞子、玻璃管、橡胶管、固定装置已省略).其中,温度计的水银球应该处于 位置.
②装置Ⅱ的作用是
(2)实验室可用甲酸制备甲酸铜.其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,
碱式碳酸铜再与甲酸反应制得四水甲酸铜[Cu(HCOO)相关的化学方程式是:2•4H2O]晶体.
2CuSO4+4NaHCO3═Cu(OH)2•CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2•CuCO3+4HCOOH+5H2O═2Cu(HCOO)2•4H2O+CO2↑
实验步骤如下:
Ⅰ、碱式碳酸铜的制备:
①步骤ⅰ是将一定量CuSO4•5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是 .www.fz173.com_2016安徽高考化学。
②步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃﹣80℃,如果看到 (填写实验现象),说明温度过高.
③步骤ⅱ的后续操作有过滤、洗涤.检验沉淀是否已洗涤干净的方法为. Ⅱ、甲酸铜的制备:
将Cu(OH)2•CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质.在通风橱中蒸发滤液至原体积的时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2~3次,晾干,得到产品.
④“趁热过滤”中,必须“趁热”的原因是.
⑤用乙醇洗涤晶体的目的是
(3)请设计实验证明甲酸具有较强的还原性: .
9.工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料﹣﹣铁红(Fe2O3),具体生产流程如下:
试回答下列问题:
(1)硫铁矿烧渣用稀硫酸酸溶时的不溶物为 (填化学式).
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有 ;
步骤Ⅳ中应选用 试剂调节溶液的pH(填字母编号).
A.稀硝酸 B.氢氧化钠溶液 C.高锰酸钾溶液 D.氨水
(3)检验步骤Ⅲ已经进行完全的试剂是 .
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是 .
(5)步骤Ⅵ中发生反应的化学反应方程式为 .
(6)欲测定硫铁矿烧渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg.
①写出加入足量的H2O2发生反应的离子反应方程式 ;
②测得该样品中Fe元素的质量分数为
【三】:安徽省皖江名校2016届高三联考化学试题(扫描版,含解析)
www.fz173.com_2016安徽高考化学。【四】:安徽六校2016届高三年级学生素质测试(化学)答案
安徽六校教育研究会2016届高三年级学生素质测试
本文来源:http://www.zhuodaoren.com/shenghuo515378/
推荐访问:2016高考化学试题 2016高考化学全国卷